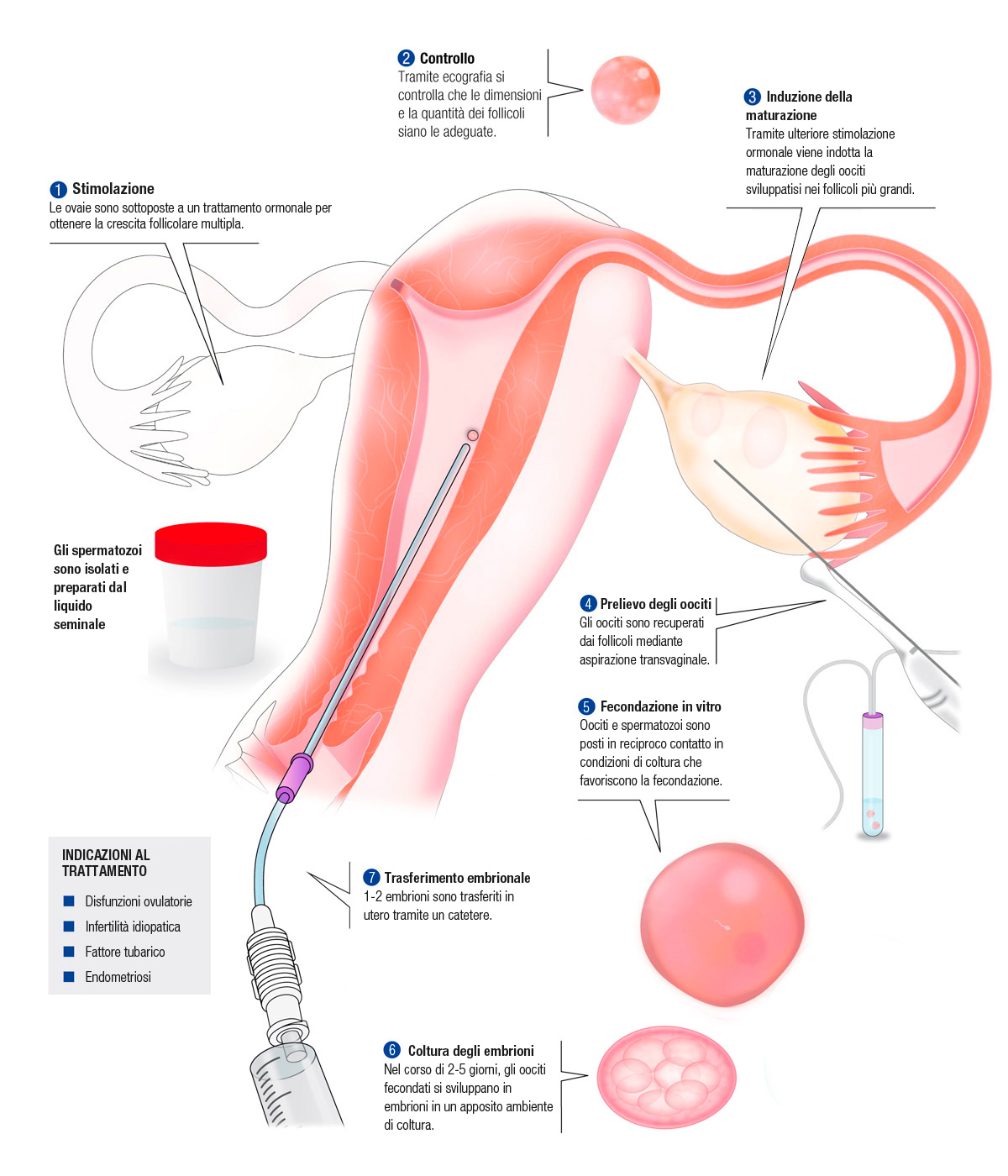
La fecondazione in vitro, detta comunemente FIVET, è una tecnica di laboratorio che consente di fecondare un ovocita mediante uno spermatozoo, all’esterno dell’utero, favorendo l’incontro tra il gamete femminile e quello maschile. A differenza dell’ICSI, che usa un solo spermatozoo per fecondare l’ovocita, inoculandolo in esso, la FIVET utilizza un campione ampio di spermatozoi favorendo l”‘incontro” con l’ovocita e un processo di fecondazione non guidato. La FIVET è una tecnica di fecondazione assistita che prevede una fase iniziale di stimolazione ovarica mediante trattamento ormonale, il monitoraggio ecografico dell’evoluzione dei follicoli e l’induzione dell’ovulazione. Gli ovociti vengono poi prelevati e fecondati in vitro mediante incontro con il liquido seminale prevalentemente prelevato e appositamente trattato. Nei 2-5 giorni successivi gli ovociti fecondati si sviluppano in embrioni che vengono trasferiti in utero.
Fecondazione in vitro: le fasi di esecuzioni di questa tecnica di PMA
La fecondazione in vitro è una tecnica di PMA molto efficace, che nei centri Biogenesi eseguiamo con successo da molti anni.
Fecondazione in vitro: la stimolazione ovarica
Nei trattamenti di PMA, in quasi tutti i casi è indispensabile stimolare l’ovaio allo scopo di sostenere una crescita follicolare multipla e disporre più di un ovocita da utilizzare. Questa strategia deriva dalla evidenza che non tutti gli oociti sono di buona qualità e non sempre la fecondazione in vitro dell’oocita produce un embrione di buona qualità trasferibile in utero. In un ciclo ovarico naturale, le normali concentrazioni dell’ormone follicolo stimolante (FSH), consentono la crescita di un singolo follicolo ovarico, quello più sensibile all’azione dello stesso ormone. Per questo motivo, la crescita di più follicoli richiede la somministrazione esogena di FSH. Nei cicli di stimolazione, l’ormone somministrato con modalità che lo rendano disponibile in circolo a concentrazioni sopra-fisiologiche e per un sufficiente numero di giorni, in modo che non soltanto crescano più follicoli, ma anche che questi raggiungano una dimensione follicolare che consenta la maturazione finale dell’ovocita. A sostegno della funzione follicolare, talvolta viene somministrato anche l’ormone luteinizzante (LH). Un aspetto critico della stimolazione ovarica consiste nell’evitare che crescenti concentrazioni di estrogeni prodotte dai follicoli in crescita provochino un’ovulazione prematura e spontanea. Tutto ciò viene evitato con l’utilizzo di molecole che antagonizzano o simulano il ruolo dell’ormone “gonadotrophin releasing hormone” (GnRH).
I farmaci GnRH-a si utilizzano secondo due schemi, definiti protocollo di stimolazione lungo e protocollo di stimolazione breve. Nel protocollo lungo, l’azione del GnRH viene fatta iniziare nella fase luteale media del ciclo precedente il trattamento, mentre nel protocollo breve il farmaco viene somministrato nel secondo-terzo giorno del ciclo di trattamento. Nel protocollo lungo la soppressione ipofisaria è ottenuta già al momento della mestruazione, in anticipo rispetto alla somministrazione di FSH che ha inizio al secondo-terzo giorno del ciclo di trattamento. Invece, nel protocollo breve l’iniziale rilascio di FSH e LH endogeno che precede la soppressione ipofisaria si sovrappone parzialmente al periodo di esposizione all’FSH esogeno.
I farmaci GnRH-ant sono usati in maniera differente rispetto alle molecole ad azione agonistica. Essi sono somministrati a partire dal quinto-sesto giorno dall’inizio del ciclo in cui si intende effettuare il trattamento, fino al momento in cui non viene indotta la fase di maturazione dei follicoli con l’ormone human chorionic gonadotropin (hCG), la cui azione è descritta successivamente in questo testo. In questo schema, l’FSH viene somministrato dal secondo-terzo giorno del ciclo, fino alla somministrazione di hCG.
Ottenuta con agonisti o antagonisti del GnRH l’inibizione del rilascio di gonadotropine endogene, la stimolazione ovarica è eseguita con gonadotropine esogene. Nella maggioranza dei casi si utilizzano farmaci basati soltanto sulla molecola dell’FSH, la cui origine può essere umana o derivare da procedimenti biotecnologici. In alcuni casi, è vantaggioso associare alla somministrazione di FSH anche quella di LH oppure si può utilizzare un farmaco noto come human menopausal gonadotropin (hMG) contenente FSH e hCG (che in parte riproduce l’azione dell’LH). Questi farmaci hanno una breve vita in circolo. Pertanto è necessario ripeterne la somministrazione quotidianamente. Pertanto è necessario ripeterne la somministrazione. Solitamente, l’assunzione di FSH viene iniziata al secondo-terzo giorno del ciclo di trattamento, protraendosi per otto-dieci giorni, anche se la durata dell’esposizione può variare significativamente. Anche le dosi giornaliere possono variare a seconda della risposta della paziente al farmaco. In pazienti con adeguate caratteristiche è possibile utilizzare una molecola di FSH ottenuta tramite tecniche biotecnologiche la cui permanenza in circolo è superiore rispetto alla molecola originale, cosa che consente una singola somministrazione all’inizio del trattamento, spesso senza ulteriori supplementi di FSH.
Indipendentemente dal tipo di soppressione ipofisaria e di schema di utilizzo delle gonadotropine, lo scopo della stimolazione ovarica è quello di favorire la crescita di un numero adeguato di follicoli (idealmente 10-12) fino allo stadio che precede l’ovulazione, corrispondente a una dimensione di 16-20 mm.
Ciò richiede anche un attento controllo ecografico ed un controllo dei livelli ormonali, mediante prelievi ematici, in modo da monitorare numero e dimensione dei follicoli. Questo tipo di monitoraggio è indispensabile per modulare e personalizzare il dosaggio delle gonadotropine somministrate durante il trattamento, ottimizzando l’esposizione al farmaco e riducendo il rischio di un’eccessiva stimolazione ovarica.
La maturazione finale degli ovociti, ovvero il processo che induce nell’ovocita modificazioni cellulari indispensabili per la fecondazione, favorisce il distacco degli ovociti dalla cavità follicolare e permette di recuperare gli ovociti per la fecondazione in vitro, si ottiene mediante la somministrazione di un farmaco, la gonadotropine corionica (hCG), molecola che mima gran parte delle azioni dell’LH, compresa quella che promuove l’ovulazione in un ciclo ovarico naturale.
Fivet: il prelievo ovocitario
Il prelievo degli ovociti avviene 36-38 ore dopo la somministrazione di hCG. In tale momento, gli oociti hanno già beneficiato dell’azione di maturazione finale promossa dal follicolo la cui azione è stata precedente stimolata dall’hCG, ma non sono stati ancora rilasciati dal follicolo stesso. Il prelievo ha un carattere modicamente invasivo. Esso richiede guida ecografica transvaginale e viene effettuato tramite un ago connesso a un sistema di aspirazione. Fatto passare in vagina, l’ago raggiunge i follicoli da aspirare dopo aver attraversato la parete vaginale. La procedura di aspirazione “follicolo per follicolo” è solitamente veloce (15-20 minuti in totale) ed i rischi emorragici o infettivi legati a questa procedura, eseguita da medici esperti, sono molto rari (minori di 1 ogni 20.000). Tuttavia, il prelievo ovocitario richiede l’uso di analgesici o di sedazione profonda per evitare inutili stress alla paziente. Il contenuto dei follicoli viene convogliato attraverso un sistema di tubi collegati all’ago di aspirazione e raccolto in una serie di provette mantenute ad una temperatura congeniale per gli oociti (37°C). Appena prelevato, il contenuto follicolare viene trasferito al laboratorio di PMA, in cui gli oociti sono individuati e posti in coltura in preparazione per la fecondazione in vitro.
Fecondazione in vitro: prelievo degli ovociti
Una volta consegnato al laboratorio, il contenuto follicolare viene immediatamente sottoposto ad osservazione per recuperare gli ovociti. Benché siano le più grandi cellule dell’organismo, gli oociti misurano solo 120 m (poco più di un decimo di mm). Pertanto la loro osservazione e manipolazione richiede l’uso di microscopi. Gli ovociti appena recuperati dal follicolo sono però inclusi in una massa denominata cumulo ooforo, di dimensioni molto maggiori (da alcuni a parecchi millimetri) e costituita da cellule follicolari (diverse migliaia). Il contenuto follicolare viene trasferito in una piastra “Petri” che viene successivamente posta sotto uno stereo microscopio per consentire le successive fasi di lavorazione. Una volta individuati nella piastra Petri a occhio nudo o tramite osservazione al microscopio, i cumuli oofori vengono isolati e posti in altro mezzo di coltura adeguato alla successiva fase di fecondazione in vitro (FIVET; in inglese, in vitro fertilization, IVF). L’impiego in laboratorio degli ovociti e degli embrioni che ne derivano richiede l’uso di specifiche tecniche di coltura. L’obiettivo di tali tecniche è riprodurre quanto più possibile le condizioni che in vivo consentono la fecondazione e lo sviluppo embrionale nella tuba e nell’utero. L’elemento fondamentale di un sistema di coltura è il mezzo cui cui oociti ed embrioni vengono a contatto. I vari mezzi di coltura possono distinguersi per diversi dettagli ma rispondo ad uno schema di formulazione generale con l’intento di soddisfare le specifiche esigenze metaboliche di gameti ed embrioni. Costituenti caratteristici ed essenziali dei mezzi sono fonti energetiche (piruvato, glucosio, lattosio), aminoacidi essenziali e non essenziali, antiossidanti, fonti proteiche (solitamente albumina o una miscela di globuline) e antibiotici. Durante la coltura, le piastre Petri sono mantenute in appositi incubatori al cui interno sono assicurate le condizioni di temperatura (37°C) e atmosferiche richieste dall’embrione e dal sistema colturale. Tra gli stress a cui potrebbero essere soggetti gli embrioni in coltura si annovera l’esposizione ad elevate concentrazioni di ossigeno. Nei vari tessuti, la tensione parziale di ossigeno oscilla intorno al 5%, valore alquanto inferiore rispetto a quello misurabile nella normale atmosfera (23% circa). Una volta isolati dopo il prelievo ovocitario e posti nelle gocce delle piastre Petri, i cumuli ovofori sono coltivati per 2-4 ore. Si suppone che tale tempo possa consentire la maturazione degli ovociti non del tutto maturi al momento del prelievo dall’ovaio.
Fecondazione in vitro: preparazione degli spermatozoi
Oltre alla crescita, maturazione e prelievo degli ovociti, la FIVET richiede la preparazione degli spermatozoi. Infatti gli spermatozoi presenti nel seme appena eiaculato non possiedono capacità fecondante, funzione che viene acquisita in vivo solo dopo alcune ore di permanenza nelle vie genitali femminili. La scoperta di questo fenomeno, noto come capacitazione, ha rappresentato per la PMA un progresso fondamentale. Nel laboratorio di PMA, la capacitazione viene ottenuta separando gli spermatozoi dal resto del campione seminale e esponendoli successivamente a specifiche condizioni colturali. La tecnica nota come “swim-up” prevede che il seme sia posto sul fondo di una provetta e che su di esso sia stratificato un equivalente volume di mezzo di coltura, facendo attenzione a mantenere ben delineata l’interfaccia tra i due fluidi. Ciò consente che gli spermatozoi mobili, che di norma sono anche i più vitali, migrino dal seme al mezzo di coltura determinando la propria separazione dalla parte liquida del seme, dagli spermatozoi immobili e da varie altre impurità cellulari o corpuscolate. Una volta migrati nel mezzo di coltura, gli spermatozoi mobili possono essere recuperati, sottoposti a lavaggio e risospesi in altro mezzo di coltura in preparazione per la FIVET. La provetta viene poi centrifugata e gli spermatozoi mobili e morfologicamente normali possono essere rinvenuti nel pellet che si accumula al fondo della provetta. Essi infatti hanno densità sufficientemente elevata da determinarne la migrazione attraverso l’intero gradiente durante la centrifugazione. Ciò non accade agli spermatozoi anomali e ad altre forme cellulari contaminanti (leucociti) presenti nel seme, che per la ridotta densità non migrano attraverso il gradiente oltre l’interfaccia esistente tra le due frazioni del gradiente. L’uso del gradiente sortisce anche l’effetto di separare dagli spermatozoi mobili particelle virali e batteri, consentendo così il trattamento anche in coppie costituite da partner siero-discordanti. Dopo il recupero dal fondo della provetta, gli spermatozoi mobili sono sottoposti a lavaggio e risospesi in un nuovo volume di mezzo di coltura, prima di essere utilizzati per la FIVET.
FIVET: il processo di fecondazione degli ovociti
Infine, la FIVET o fecondazione in vitro, viene semplicemente eseguita inoculando un numero sufficiente di spermatozoi (circa 100.000/ml) in ciascuna delle gocce di coltura contente i cumuli ovofori precedentemente recuperati. La particolare caratteristica del mezzo in cui avviene la fecondazione è quella di contenere elevate concentrazioni di glucosio, necessario per la mobilità e capacitazione degli spermatozoi. In questo terreno i gameti sono coltivati per circa 16-18 ore, momento dopo del quale si verifica la presenza di due pronuclei, organelli che indicano la presenza del patrimonio genetico maschile e femminile nell’ovocita fecondato e che pertanto “certificano” l’avvenuta fecondazione.
Lo sviluppo dell’ovocita fecondato in embrione può essere protratto in vitro la massimo per 5-6 giorni. Durante i primi 2-3 giorni di sviluppo, l’oocita fecondato si divide in cellule approssimativamente sferiche (blastomeri) e ben definite e apparentemente tra loro identiche. In condizioni ideali, in un embrione si contano quattro cellule all’inizio della seconda giornata e otto cellule all’inizio della terza. Questo schema può però subire parecchie variazioni. Un numero di cellule inferiore a quello atteso, dimensioni diverse tra le cellule e la presenza di frammenti citoplasmatici sono fenomeni frequenti e talvolta sintomatici di compromessa vitalità embrionale. A partire dallo stadio di 8 cellule, lo scenario cambia. I blastomeri stabiliscono contatti intercellulari molto stretti (tight junctions), stabilendo una barriera funzionale tra una cavità interna in via di formazione (blastocele) e l’ambiente esterno. L’intera organizzazione e fisiologia embrionale mutano, passando da uno stato in cui le cellule sono essenzialmente sotto il controllo di informazioni genetiche (RNA) di origine materna accumulate durante l’oogenesi, ad una condizione in cui l’embrione è organizzato in una sorta di epitelio le cui cellule esprimono nuove funzioni dirette da RNA di nuova sintesi. Coerentemente, anche il profilo metabolico muta, il cui livello aumenta per effetto dell’attività di trasporto di molecole e ioni tra blastocele ed ambiente esterno, oltre che per l’incremento complessivo delle attività biosintetiche.
Se fino alla metà degli anni novanta le tecniche di fecondazione in vitro si sono avvalse di sistemi di coltura comportanti l’impiego di un solo mezzo per tutte le fasi di sviluppo, i cambiamenti della fisiologia dell’embrione hanno ispirato il concetto che lo sviluppo nel corso di 5-6 giorni debba essere sostenuto con mezzi di coltura caratterizzati da diversa composizioni chimiche, specificamente più idonee alle diverse fasi. Pertanto in molti laboratori gli embrioni sono trasferiti sequenzialmente in 2-3 mezzi di coltura all’inizio della prima e all’inizio della terza giornata.
Al quinto giorno di sviluppo l’embrione è costituito da una sfera cava la cui sottile parete (trofoectoderma) mostra un accumulo di cellule in una singola area (massa cellulare interna). Nel corso del successivo sviluppo il primo formerà gli annessi embrionali, mentre la seconda darà luogo all’embrione vero e proprio.
Fecondazione in vitro: trasferimento dell’embrione in utero
Gli embrioni ottenuti dopo la fecondazione in vitro possono essere trasferiti in utero in qualsiasi momento dello sviluppo in vitro a partire dalla seconda giornata, ma solitamente il trasferimento viene effettuato in terza o quinta giornata. Per scongiurare l’insorgenza di gravidanze trigemine o di ordine superiore, le attuali norme di buona pratica medica raccomandano il trasferimento di massimo due embrioni, con qualche eccezione.
L’atto del trasferimento è manualmente semplice. L’embrione viene prelevato dalla piastra di coltura e caricato dall’embriologo in un catetere che a sua volta viene consegnato al medico. Infine, talvolta dietro guida ecografica, il medico deposita l’embrione nell’utero della paziente facendo passare il catetere attraverso la vagina e il canale cervicale. Il tutto si conclude velocemente e in maniera indolore. A sostegno della funzione uterina in caso di impianto, alla paziente viene chiesto di seguire una terapia con progesterone almeno per i 15 giorni successivi al trasferimento, momento in cui viene eseguito il primo test di gravidanza. Da questo momento, in caso di gravidanza, il processo è identico a quello di qualsiasi gravidanza ottenuta in maniera naturale.


